-
 核酸分子计算
核酸分子计算韩达 研究员 上海交通大学
为了处理海量的数据信息,人类的计算能力不断发展,其中的一个特点是计算模式正逐渐从硅基过渡到碳基,从微纳芯片过渡到分子芯片。利用核酸分子的信息处理能力来代替数字开关的功能,则构成了核酸分子用于信息存储与计算的基本指导思想·从本质上讲,核酸分子具有高效的分子识别、信息存储与并行性运算能力可实现精细、智能和复杂的分子识别与计算,可以在不需要人工干预和复杂仪器的情况下完成“样本入-结果出”式的疾病诊断,这些特点为开发智能核酸分子诊断系统提供了广阔的前景。复杂生命体系中包含多种与疾病相关的核酸、蛋白质等分子信息,这些分子在生理病理进程中发挥重要作用。从复杂样本中高灵敏检测这些分子信息以及发现分子信息与疾病的关联,可以为疾病精准诊疗提供科学依据与技术支持,也可大大提高重大疾病的诊治成功率。目前,疾病的分子诊断需要利用PCR、ELISA 等高灵敏的检测手段实现多个靶标物的分次测量,然后由数据处理软件或专业人员来对靶标物的种类与浓度信息进行处理,建立与疾病的关联。这类方法存在着若干缺点:(1)靶标物的分次测量会产生实验误差,容易丢失痕量的分子信息;(2)需要专业的人员与工具来处理数据·无法实现快速、居家化的诊断。为解决上述问题,我们利用机器学习方法在大量样本库中找到了疾病的精准诊断模型,利用建的可实现数据分类算法的核酸计算方法!设计了可对多种标志物(micrORNA'mRNA)表达谱进行差异分析的核酸分子计算方法,系统研究了其在肺癌、胰腺癌和急性呼吸系统感染等疾病的分子诊断中的应用,预期可以激发更多的临床应用,为疾病的无创、智能化分子诊断提供了新途径。 -
 血红细胞的膜骨架组装的结构基础
血红细胞的膜骨架组装的结构基础高宁 教授 北京大学
动物细胞中存在一种以血影蛋白 spcctrin 为基础的二维网状形式的膜骨架系统。膜骨架平行于细胞膜分布,紧贴在细胞膜内侧,赋予细胞膜更高的机械强度和可塑性。膜骨架与细胞膜的功能活动密切关联:通过与膜蛋白的互作,膜骨架可以调控膜蛋白在细胞膜上的定位,促进膜蛋白聚簇形成高级组织形式,同时也参与调控细胞对外界信号的响应,基于膜骨架在细胞膜的机械强度和代谢活动中的关键角色其功能的素乱与多种人类疾病密切相关。负责膜骨架组织的核心复合物junctional complex的研究工作较多,但是其中这些参与的因子的精的分子角色和功能机制有待进一步的研究。高宁课题组成功从猪血红细胞中分离出了膜脂被完全清除、在冷冻电镜条件下具有较好分散度的膜骨架网格,对这一完整的内源膜骨架系统进行了冷冻电镜结构分析,最终获得了junctional complex的高分辨结构'揭示了junctional complex 和膜骨架组装的分子细节,释了其组成因子在膜骨架组装和稳定性维持方面的分子机制。 -
 新型宿主防御肽模拟物聚嘧唑啉功能研究
新型宿主防御肽模拟物聚嘧唑啉功能研究刘润辉 教授 华东理工大学
微生物感染长期伴随着人类发展并在世界范围内广泛存在“多重药菌不断在临床实践中快速出现'是全人类面临的巨大挑战。研制高效抗菌且不易出现微生物附药性问题的新型抗菌剂刻不容缓且极具挑战。存在于多种生命体的宿主防御脑(HDP)具有广谱的抗菌活性和调节免疫功能,作为新型抗菌剂在研究和解决微生物附药性难题上被寄予厚望·但由于其不耐酶解、价格贵、难以大量制备等缺点限制了实际应用·我们发现聚噁唑啉可以作为一类新的多肽模拟物,并展示唑啉可以模拟HDP获得优异抗菌活性·先后发现优选亲噁唑啉可具有高效抗酣药细菌和耐药真菌的功能。优选化合物展示了媲美、甚至优于对照抗菌药物的活性,良好的生物安全性,连续使用也未发现造成细菌和真菌产生附药性问题。并在动物活体实验中验证了有效的体内抗耐药细菌、真菌感染功能,尤其是治疗系统性、侵入性感染的功能这些研究表明模拟HDP的聚噁唑啉在抗菌药物和生物材料领域具有广泛应用前景。 -
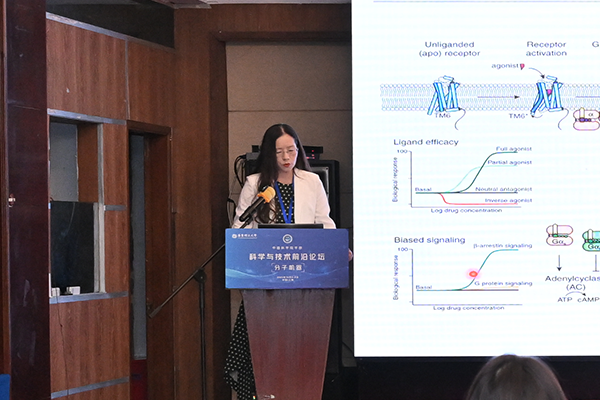 Signal transduction and arrestin-mediated modulation of the glucagon receptor
Signal transduction and arrestin-mediated modulation of the glucagon receptor吴蓓丽 研究员 中国科学院上海药物研究所
Shanghai Institute of Materia Medica, Chinese Academay of Sciences Beili WuIn response to a vast array of agonists, G protein-coupled receptor (GPCRs) activate heterotrimcric G proteins to initiate various downstream signaling pathways. To avoid overstimulation, a GPCR kinase induces phosphorylation of the receptor to triggerrecruitment of β-arrestin (βarr), which desensitizes G-protein activation and mediates receptor internalization. It has been proposed that the arrestin binds to the receptor in twodifferent conformations,“tail” and “core",which were suggested to govern distinct processes of receptor signaling and traffcking. However, little structural information is available for the tail engagement of the arrestins, Here we report two structures of the glucagon receptor(GCGR)bound tob-arrestin1(barrl)in glucagon-bound and ligand-free states. These structures reveal a receptor tail-engaged binding mode of barrlwith many unique features never observed, Helix Vll of GCGR, instead of the receptorcorc, plays a major role in accommodating barr1 by forming extensive interactions with the central crest of barr1. The tail-binding pose is further defined by a close proximity between the barr1 C-edge and receptor helical bundle,and stabilized by a phosphoinositide derivative that bridges barr1 with helices I and Vll of GCGR. Lacking any contact with the arrestin, the receptor core is in an inactive state and loosely binds tothe agonist glucagon. Further functional studies suggest that the tail conformation of GCGR-barr governs plasma-membrane barr recruitment and endocytosis of GCGR, and provides a molecular basis for the receptor forming a super-complex simultaneously with G protein and barr to promote sustained signaling within endosomes. These findings grcatly extend our knowledge about the arestin-mediated modulation of GPCR functionalities. -
 框架核酸生物传感
框架核酸生物传感左小磊 教授 上海交通大学
生物探针的界面状态是否均一、可控一直是制约生物传感发展的关键问题,直接关系着生物探针的识别效率、识别速度和特异性等关键指标。我们致力于将框架核酸与界面生物分子的自组装精确调控相结合,可以在纳米级精度,实现生物分子的界面状态调控(包括对生物探针的组装密度,空间取向等)。在利用四面体框架核酸作为生物传感新平台的基础之上,我们设计了一系列具有不同尺寸大小的新型四面体,可在 2.38-12.8纳米之间精确调控 DNA探针之间的纳米距离· 并通过电化学、荧光、原子力显微镜、超分辨显微镜等技术对这种界面进行了表征与测定,并深入探讨了 DNA 探针的识别效率和速度与探针之间距离的密切关系。纳米级精调控保证了传感界面的快速传质过程,而在宏观尺度的制备保证了极低浓度的靶分子与探针的碰撞几率,充分利用框架核酸精可调的特点,进一步发展了针对蛋白质核酸(DNA/RNA)、小分子等不同分子水平靶标的高灵敏检测方法。基于这一精确组装策略发展的通用生物检测平台为实现多分子水平肿瘤标志物的联合奠定了基础,为实现癌症早期精准检测提供了强有力的工具。
第147次:分子机器
论坛执行主席
-
 田禾院士
田禾院士
-
 饶子和院士
饶子和院士
-
-
-
-
主题报告
主办单位:中国科学院学部学术与出版工作委员会
技术支持:中国科学院计算机网络信息中心
关于学术引领网站上的任何文字、图片、视频资料的使用必须经过中国科学院学部工作局的许可
© 1996 - 中国科学院 版权所有 京ICP备05002857号-1 京公网安备110402500047号
通讯地址:北京市海淀区中关村北一条15号(100190)


